- 概述
- 理由
- 解答问题
- 应用指南
- 发表文章
评估t细胞对肿瘤相关抗原的特异性对于开发针对癌症的个性化免疫疗法至关重要。应用多参数表面等离子体共振(MP-SPR)技术表征肿瘤特异性CD8+ t细胞中t细胞受体(TCR)的相互作用。完整的活细胞被捕获到由肽-主要组织相容性复合物(pMHC)功能化的人造细胞膜组成的仿生表面上。在4个不同的t细胞群体中完成了TCR和pMHC之间免疫突触形成的实时亲和分析。
简介
表面等离子体共振(SPR)是一种成熟的技术,用于实时和无标记地测量结合亲和力和动力学。多参数表面等离子体共振(MP-SPR)仪器可以在宽角度范围(40-78度)和多个波长范围内进行测量,从而能够评估从小分子到活细胞的各种相互作用。该技术可用于各种创新应用,例如表征与活细胞的相互作用(在传感器上培养或在流动中捕获),以及确定生物层的厚度,包括脂质双层和生物材料的构象变化。
t细胞在人体免疫防御系统中发挥着重要作用,它们的激活引发了适应性免疫反应。t细胞在tcr与抗原肽相互作用时被激活,抗原肽由肿瘤细胞或抗原提呈细胞中的主要组织相容性复合体(MHC)呈现。肿瘤相关抗原特异性免疫细胞具有增强的抗肿瘤活性,为癌症个性化免疫治疗的发展奠定了基础。这种创新疗法旨在激活肿瘤特异性t细胞,帮助患者自身免疫系统攻击癌细胞。成功的免疫治疗需要可靠的TCR-pMHC结合参数来评估治疗的特异性和安全性。
材料和方法
使用MP-SPR Navi™210A VASA仪器进行测量,配备3种激光波长(每个流通道分别为670、785和980 nm)。Krebbs EDTA缓冲液流速为10 μl/min,测量温度为16℃。
基于细胞的检测采用3种不同的传感器格式(图1):1. 金包覆聚乙二醇化烷硫醇(SAM -自组装单层);2. 负载脂质双分子层(SLB)表面功能化SiO2;3. 金包覆杂化双层膜(HBM)。
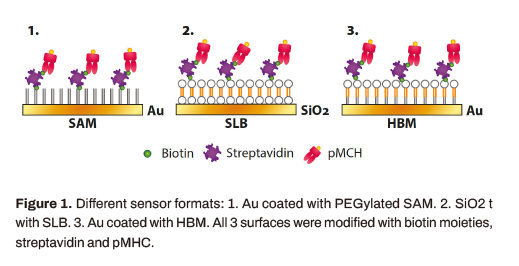
所有3层都用生物素修饰,通过链霉亲和素介导的结合,使生物素- pmhc复合物(装载NY-ESO-I157−165抗原的HLA-A0201单体)固定化。以PEG-SAM表面为参照,以功能性SLB和HBM为仿生平面基质,测定t细胞受体结合情况。
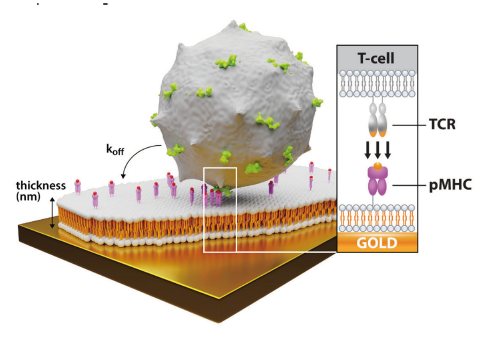
将人肿瘤特异性CD8+ t细胞以102 ~ 105个/mL的细胞密度注射25 min后加载到细胞表面。注射后时间设置为10分钟。连续注射增加细胞密度的4种不同细胞群,其中WT(野生型),DMβ和V49I是不同的TCR变体,而T1φ作为阴性对照。
结果和讨论
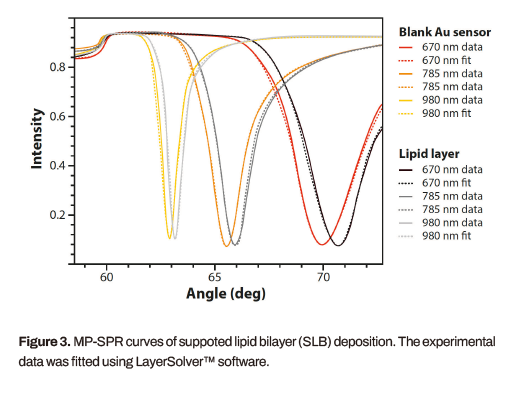
基于脂质的传感器表面在原位生成,并用专用的LayerSolver™软件表征层的形成。SLB膜的厚度为5.65 nm, HBM层的厚度为1.95 nm下层的烷硫醇SAM,实际脂质亚层的厚度为2.88 nm。三种激光波长下SLB沉积的MP-SPR曲线及拟合如图3所示。与聚乙二醇化的SAM表面相比,SLB和HBM表现出更好的细胞检测灵敏度和更高的特异性细胞捕获水平。
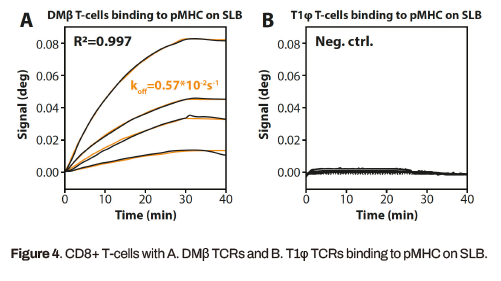
对所有被测试的细胞群进行t细胞与pMHC功能化表面结合的实时动力学分析。二维结构解离动力学证明了三种肿瘤特异性CD8+ t细胞(WT, DMβ, V49I)的不同亲和力。表1给出了两种仿生表面上不同CD8+ t细胞变体的TCR与pMHC复合物结合的动力学值。获得的数据与之前发表的计算机研究一致。DMβ t细胞特异性结合pMHC见图4a。阴性对照T1φ t细胞未与pMHC结合(图4b)。本文所描述的方法在t细胞群体的原位检测和使用MP-SPR技术的结合亲和力表征方面表现出出色的特异性和选择性。
结论
在本研究中,在传感器表面生成仿生SLB和HBM层,并通过MP-SPR确定层的厚度。不同变体的肿瘤特异性CD8+ t细胞被成功捕获到pMHC功能化的表面上,并测量了TCR对pMHC复合物的结构亲和力。基于MPSPR的方法已被证明是测定膜受体抗肿瘤活性的有效工具,并可能加快癌症免疫治疗的发展步伐。BioNavis仪器可以在生理相关条件下、可控温度(15 ~ 45℃)、静态或动态流动条件下进行基于细胞的测量。因此,MP-SPR技术是基于活细胞的检测的有力工具,对于开发新的细胞疗法和生物材料至关重要。
