- 概述
- 理由
- 解答问题
- 应用指南
- 发表文章
G蛋白偶联受体(gpcr)是一个跨膜蛋白大家族,参与许多生理和病理过程。细胞外刺激导致细胞反应,导致细胞内内容物有序和动态的再分配。细胞反应是受体类型特异性的。因此,将gpcr分为Gi/o、Gq/11、Gs和G12/13四个亚类。
实时无标记的细胞分析提供了亚型特异性的概况,而不需要标记。然而,可用的检测方法是基于附加拮抗剂或其他反应修饰剂的多步骤分析,这在尚未发现特定途径的拮抗剂的情况下尤其成问题。
多参数表面等离子体共振(MP-SPR)是一种实时无标记检测方法,可以检测传感器表面的变化,如配体结合、分子重排和细胞粘附。由于其多参数方法,可以实时跟踪多个参数(图1)。例如,峰值角位置信号(PAP)检测GPCR激活期间细胞中发生的细微质量重分布。相反,峰值最小强度(PMI)受SPR耦合角反射回的光量的影响。通过这种方式,不同的MP-SPR反应单独或相互结合,可以在单步分析中研究不同的GPCR途径,而无需事先进行细胞处理,使用拮抗剂或途径调节化合物。

图1:MP-SPR仪器可以连续测量全SPR曲线,并可以实时跟踪多个参数,包括峰值角位置信号(PAP)和峰值最小强度(PMI)。
材料和方法
将离体细胞悬液移至SPR102-AU传感器上,将HeLa、CHO-K1或A431细胞固定在SPR102-AU传感器上。对于HeLa细胞,首先用人纤维连接蛋白包裹传感器。带细胞的传感器在37℃下培养至完全融合。光镜下观察细胞融合、形态学和单层完整性。
测量采用MP-SPR Navi™220A NAALI仪器,流速为20-30 μL/min,温度为37℃。运行缓冲液相当于用于细胞培养的基础培养基。样品注射15分钟。不含活性化合物的参比样品被注入第二个通道。实验结束后,用台盼蓝处理细胞,在显微镜下观察细胞活力。
结果和讨论
A431细胞受到缓激肽和肾上腺素的刺激。缓激素与缓激素B2受体结合,激活Gq通路,而肾上腺素与β2肾上腺素受体结合,激活Gs通路(图2)。不同浓度的肾上腺素和缓激素刺激A431细胞导致独特的时间依赖性PAP谱(图3)。组胺结合组胺H1和H3受体,分别激活Gq和Gi通路。这导致了同样独特的PAP谱(数据未显示)。
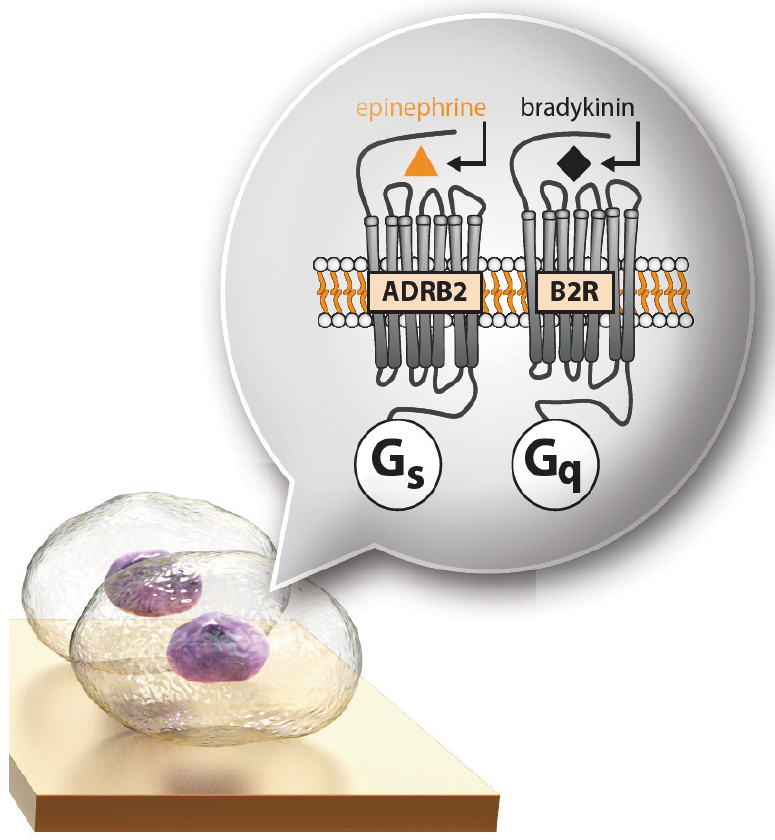
图2:肾上腺素刺激β2-肾上腺素受体激活Gs通路,缓激素B2受体激活Gq通路。
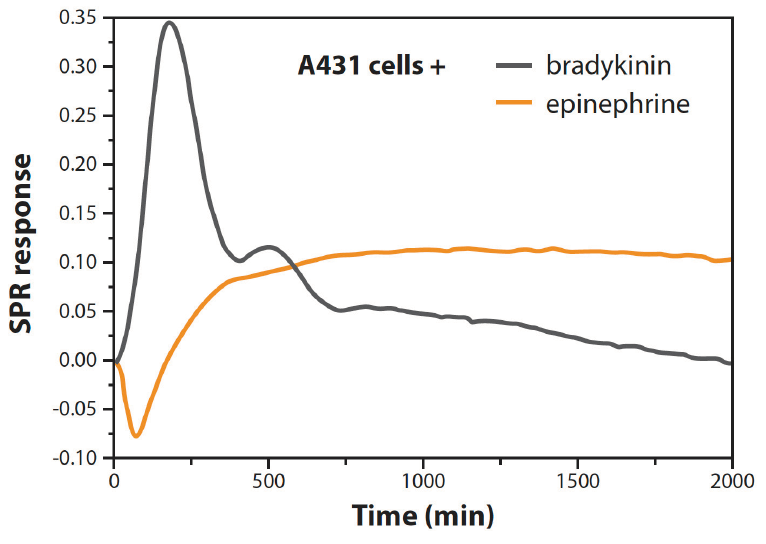
图3:用缓激素或肾上腺素刺激A431细胞可产生独特的PAP谱。
除了PAP,其他几种SPR信号反应也表现出一致的和通路依赖的变化。当绘制这些信号响应与PAP响应的对比图时,尤其是PMI,每个分析的GPCR信号通路都有明确的可区分模式(图4)。
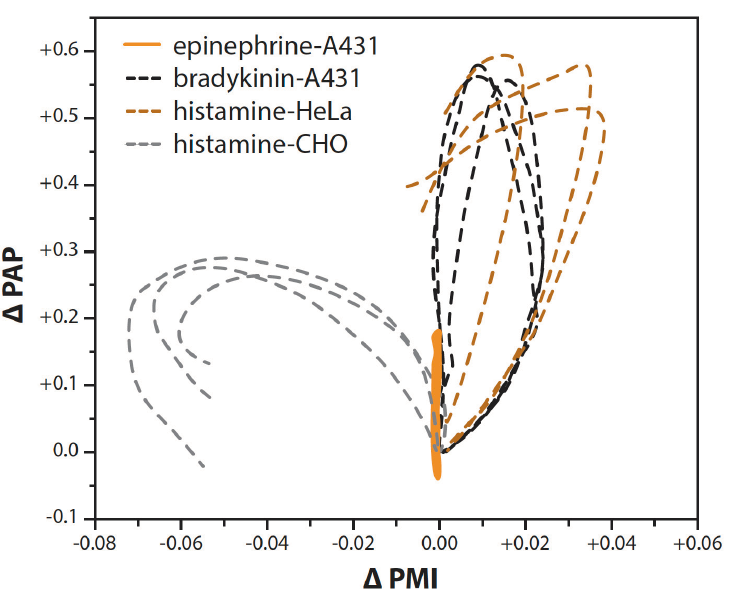
图4:双参数PMI-PAP反应谱,其中PAP(峰值角位置)反应与PMI(峰值最小强度)反应相对应,显示不同激动剂和细胞系的明确可区分模式。
为了证实观察到的细胞反应是特异性的gpcr,细胞要么用组胺受体拮抗剂和G蛋白抑制剂处理,要么不转染组胺受体。结果,这些细胞对300nM组胺处理没有反应。
将MP-SPR PAP响应与使用谐振波导光栅(另一种用于无标签细胞测量的光学方法)测量的响应进行比较,发现了相似的浓度响应曲线。
总结
由于其在生理过程中的核心作用,gpcr作为新药物化合物的靶点被广泛研究。结合全SPR曲线峰的动态角度(PAP)和强度(PMI)变化,MP-SPR用于将活细胞中活化的gpcr分离成亚型特异性信号通路,而不使用拮抗剂或其他反应调节剂。
